Мышьяк в жизненном цикле медоносной пчелы
Исследования круговорота мышьяка в природе были развернуты в 70-е годы. Эти работы тесным образом связаны с изучением процессов биометилирования и окисления-восстановления в различных субстратах окружающей среды, а также с исследованием циклов других токсических элементов (Hg, Co, Se и т.д.). Общая схема геоциклов, по которым токсические элементы перемещаются в природе и, выходя из которых, могут усваиваться растениями и животными, предложена Вудом.
Деятельность человека может оказать значительное влияние на геоцикл, нарушить сложившееся динамическое равновесие, то есть нарушить баланс между синтезом и разложением.
Мышьяк относится к элементам со средней относительной подвижностью в окисляющей кислотной и нейтральной (до щелочной) средах, и к элементам с очень низкой относительной подвижностью в восстановительной среде.
Основные пути проникновения мышьяка в растения - всасывание корнями из почвы и адсорбция из атмосферы листьями. Первый путь является основным, причем, всасывание мышьяка из песчаных почв протекает более эффективно, чем из глинистых. Поэтому содержание мышьяка в растениях не соответствует его концентрации в почвах.
Объектом исследования является вид Apis mellifera - пчела медоносная, у которой существует ряд преимуществ при работе (Г. В. Ломаев, Т. Г. Габричидзе, Н. В. Бондарева, Л. М. Колбина, П. А. Третьяков, 2005).
Пути, по которым мышьяк и железо могут попасть в пищу пчел, - выпадение загрязненных осадков на цветы, занос с воздухом в улей, на росу или в водоем, откуда пчелы берут воду. Помимо этого, мышьяк и железо могут попасть в пищу пчел через трофические цепи по пути «водоем - почва - растение - нектар». Данный путь возможен и при разливе загрязненных веществ на почву или в водоем.
При попадании люизита в ОПС происходит его разложение, могут образовываться простые неорганические вещества типа арсенатов и арсенитов.
Имеются немногочисленные литературные данные только о реакции пчел на мышьяксодержащие ядохимикаты. Этому посвящена пчеловодческая литература. Больше сведений о влиянии таких загрязнителей как Pb, Cu, Zn, Fe. Еще меньше (их практически нет) сведений о действии мышьяка и других загрязнителей на ферменты пчел, их морфометрические характеристики, как в стадии имаго, так и на других стадиях. Действие избытка железа в онтогенезе пчел, поступающего с пищей, рассмотрено в работах Н. В. Бондаревой. Эти данные очень важны, так как железо и мышьяк являются антагонистами. Железо образует с мышьяком труднорастворимые, а, следовательно, труднодоступные живым организмам соединения. С другой стороны, есть вещества, которые усиливают действие мышьяка - например, свинец.
Нами были получены сведения, характеризующие мышьяк как кумулятивный яд при малых концентрациях. Так, при действии мышьяка (арсената кальция) на пчел с концентрацией на 2, 1.5, 1 мг/л, смерть наступала на 5-7-ые сутки. До этого периода не было зарегистрировано ни одной погибшей пчелы. В контрольных группах смертность пчел на начальных этапах была более высокой, но не такой массовой.
Проведенные опыты свидетельствуют о хроническом токсическом действии мышьяка с концентрацией 1,6, 0,9, 0,4 мг/л. Мышьяк вводили с сахарным сиропом. При поступлении с сиропом мышьяка в данных концентрациях происходит постепенное накопление токсических эффектов. У пчел отсутствуют явные проявления токсического эффекта в течение недели. Проявление этологических реакций заключается в неохотном потреблении сиропа с мышьяком и более вялом общем поведении.
Отличительной особенностью явилась гибель всех пчел в один день. Данная особенность говорит о том, что при загрязнении окружающей среды мышьяком в малых концентрациях токсический эффект проявится через определенный период. Если загрязнение будет разовым, то эффект будет неоднозначным. Для ответа на этот вопрос нужны более детальные исследования.
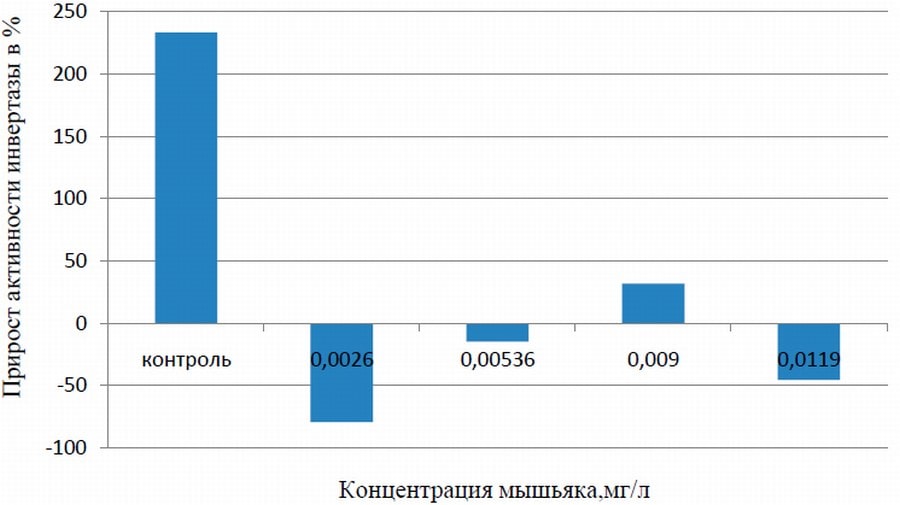
Рис. 1. Изменение активности инвертазы на графике
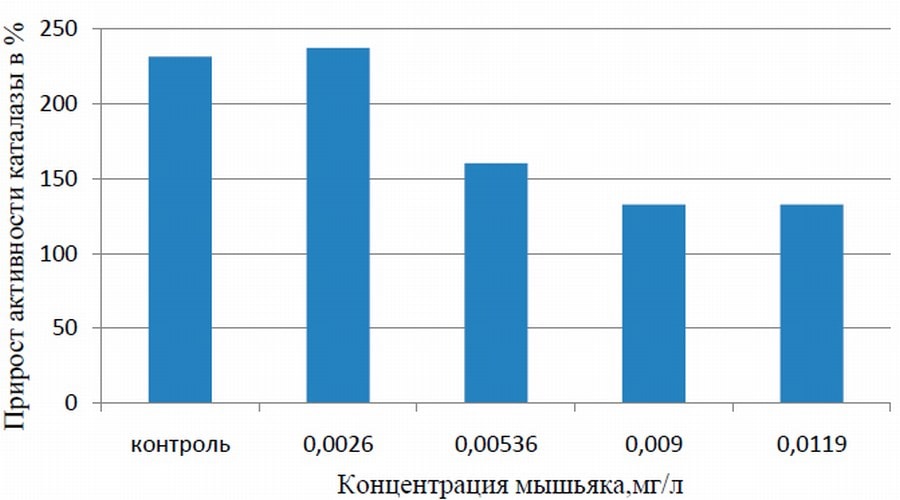
Рис. 2. Изменение активности каталазы.
Анализ действия мышьяка на пчел
Анализ действия мышьяка в очень низких концентрациях на пчел можно оценить с помощью ферментов, поскольку использование биохимических тест-функций позволит выявить первичные молекулярные механизмы действия веществ-загрязнителей и пути биодетоксикации промышленных ядов, детерминирующие возможность адаптации к ним различных организмов (И. Л. Цветков, С. Л. Зарубин, Г. А.Урванцева, А. С. Коничев, Ю. Б. Филиппович,1997). В качестве анализируемых систем выбраны ферменты инвертаза КФ 3.2.1.26 и каталаза КФ 1.11.1.6. (Диксон М., Уэбб Э.,1982.). Данные ферменты хорошо изучены и активно используются при различных диагностиках состояний пчел, также известна их динамика.
Нами были получены следующие результаты. На рис. 2 значения представлены в процентном виде, так как идет сравнение показателей между собой. За 100% были приняты первоначальные активности ферментов, исходя из которых, высчитывался прирост активности. Очень интересны данные о действии As на фермент инвертаза, выделяемый слюнными железами пчел. Данный фермент отвечает за расщепление сахарозы, которая поступает с пищей (сиропом или нектаром). Имеются данные об арсенолитическом действии мышьяка, прежде всего, в процессах гликолиза, а также на ранних его стадиях. Эта теория базируется на сходстве арсенат- и фосфатионов , которые принимают участие в расщеплении моносахаров. Еще в начале ХХ века были получены данные об ускорении брожения сахара. Ускорение гликолиза арсенатом наблюдается уже при концентрации 0,0002 моль/л - повышается утилизация сахара, а при концентрациях арсената 0,001-0,002 моль/л наблюдается наибольшее активирование гликолиза. Высокие концентрации, начиная с 0,01 моль/л, угнетают гликолиз (Гамаюрова В. С.,1993.).
Эффект действия мышьяка
Эти данные согласуются с полученными. При концентрации 0,00268 мг/л (№1 на рис. 1) наблюдается снижение активности инвертазы на 312,3% по отношению к контролю. Это можно трактовать как положительный арсенолитический эффект, поскольку пчелам не нужно вырабатывать так много данного фермента. Хотя, сироп, даваемый пчелам, состоит из сахарозы, которую и расщепляет инвертаза. Ее активность должна возрасти во много раз, что мы и видим в контроле (№5, рис. 1). Постоянное кормление пчел сахарным сиропом может привести к деградации слюнных желез. Так что, данная доза предотвращает этот процесс (Н. И. Кривцов, В. И. Лебедев, Г. М. Туников,1999).
При повышении концентрации As в сиропе (№2 - 0,0536 мг/л, №3 - 0,009 мг/л, рис. 1), наблюдается увеличение активности фермента по отношению к семье №1, примерно в 3 и 5 раз соответственно. Таким образом, пчелами осуществляется компенсаторный механизм в ответ на угнетение гликолиза. Возможно токсическое действие на другие системы организма
Доза, полученная пчелосемьей №4 максимальной концентрации (0.01198 мг/л), явно вызывает отрицательный эффект, так как активность фермента инвертазы вновь падает и составляет отрицательный прирост - 45%. Организм пчел не справляется с такой дозой мышьяка. Возможно недостаточное усвоение моносахаров и недостаточное расщепление дисахаров, а также общее токсическое угнетение.
Эффекты, вызываемые действием мышьяка на каталазу, имеют другое распределение (рис. 2). Наблюдается постепенное снижение активности фермента с +273% до +132...+160%, при увеличении поступления мышьяка от 0,00536 до 0,01198 мг/л. Возможно, эти эффекты связаны с антагонистическим взаимодействием Fe и As, так как каталаза - это железосодержащий энзим. Механизм снижения активности энзима может быть связано с расходованием железа на образование нерастворимых комплексов с мышьяком для нейтрализации токсичности последнего.
Каталаза является важным приспособительным механизмом пчел и всех живых организмов. Она осуществляет процессы нейтрализации перекисей, образующихся при распаде веществ. Чем выше показатель активности этого фермента, тем меньше будет сказываться отрицательное действие перекиси водорода, а клетки тканей не будут испытывать дефицита в кислороде (Н. С. Чернов, Е. А. Смольникова, 2003).Нарушение ее выработки и снижение активности приведет к негативным последствиям зимовки, которая является основополагающей для следующего сезона (Ю. К. Барбарович,1993).
Концентрация, полученная семьей №1 (0,00268 мг/л), не вызывает значительных отклонений активностей фермента от нормы (№5 на рис. 2).
На основании данных результатов мы сделали следующие выводы:
- пчелы приспособлены и могут активно справляться с очень низкими концентрациями мышьяка (0,00268 мг/л); за счет ускорения гликолиза их организм тратит меньше силы на выработку инвертазы; активность каталазы - в пределах нормы;
- увеличение дозы вызывает компенсаторные реакции в организме пчел, выражающиеся в повышении активности фермента инвертазы и понижении активности каталазы.
Первый эффект связан с борьбой организма пчел с ингибированием мышьяком гликолиза. Второй - с расходованием железа из фермента на связывание мышьяка в нерастворимый комплекс.
С концентрацией 0,01198 мг/л пчелы не справляются, и их функции угнетаются. Падает активность инвертазы и каталазы. Еще раз подтверждена более высокая чувствительность пчел к загрязнителям. Этот факт важен при выборе объекта для мониторинга окружающей среды.
Надо учитывать, что на процесс интоксикации действует эффект группы. Так как пчелы - общественные насекомые, то особи, находящиеся в изоляции, погибают гораздо быстрее. При использовании апипостов численность пчелосемьи должна быть оптимальной.
Острый токсический эффект имеет концентрация арсената кальция 0,68 г/л: элиминация всех особей происходит через сутки.
Постоянное магнитное поле, усиленное относительно земного в 2 раза, усиливает токсический эффект мышьяка (концентрация арсената кальция составляет 0,68 г/л). Время элиминации при совместном действии мышьяка и магнитного поля составляет 6 часов. Тогда как действие мышьяка с такой же концентрацией приводит к полной гибели пчел только через сутки.
Миграция мышьяка изучена не в полном объеме. При очень низких концентрациях мышьяка в сиропе (до 0,009 мг/л) он фильтруется пчелами. Содержание его в теле пчелы увеличивается многократно. В меде же его концентрация падает. При увеличении поступления мышьяка до 0,01198 мг/л этот процесс нарушается. Концентрация мышьяка в теле пчелы заметно падает, в меде, наоборот, увеличивается. Следовательно, нахождение мышьяка в меде зависит более линейно от увеличения концентрации его в окружающей среде, чем в теле пчелы. Пчелы являются своеобразным барьером на пути миграции мышьяка из окружающей среды в мед (возможно, и в другие продукты жизнедеятельности пчел). Данный механизм нарушается при увеличении поступления мышьяка. Похожий «скачок» наблюдался при измерении активности фермента инвертазы.
По экотоксикологическому исследованию медов Камбарского района за 2005 и 2006 годы замечены следующие особенности. В деревне Но- вокрещенка за данный период времени концентрация мышьяка снизилась, а в д. Гоголи, наоборот, повысилась, как и в д. Балаки. В пробах меда, взятого вблизи г. Камбарка, мышьяк обнаружен в различных концентрациях, отличающихся на порядок. В среднем, концентрация мышьяка в медах за год увеличилась на 36%. Анализ меда производился в аккредитованной лаборатории «Удмуртский ветеринарно-диагностический центр».
ГОУ ВПО Ижевский государственный технический университет
Литература:
- Активность каталазы у пчел среднерусской, серой горной кавказской, карпатской пород и их помесей. / Чернов Н. С., Смольникова Е. А. // Новое в науке и практике пчеловодства. Рыбное: ГНУ НИИП Россельхо- закадемии, 2003. - 106-108 с.
- Апимониторинг загрязнения окружающей среды./Ломаев Г. В., Габ- ричидзе Т. Г., Бондарева Н. В., Колбина Л. М., Третьяков П. А. // Апидоло- гия и пчеловодство. Выпуск 1.Ижевск: Ассоциация «научная книга», 2005. -126 с.
- Барбарович Ю.К. Тайны пчел. - СПб. : Петроградский и К, 1993.-190с.
- Гамаюрова В. С. Мышьяк в биологии и экологии.- М.:Наука,1993. - 207 с.
- Глобальная экология: учебное пособие / Никоноров А. М., Хоружая Т. А. - М: Кн. Сервис, 2003. - 284 с.
- Диксон М., Уэбб Э. Ферменты: В 3-х томах. М.:Мир, 1982.Т. 2. - 806 с.
- Кривцов Н. И., Лебедев В. И., Туников Г. М. Пчеловодство. - Москва: «Колос», 1999.
- Методика прогнозирования зимостойкости пчелиных семей по активности каталазы ректальных желез. / Жеребкин М. В. // Информационный листок УДК 638.1. - Рязань, 1970. - 8 с.
- Методы проведения научно-исследовательских работ в пчеловодстве. - Рыбное, 2003.
- Физиологический контроль за степенью подготовленности пчел к медосбору. /Жеребкин И. В. // Информационный листок УДК 638.1. - Рязань, 1970. - 4 с.
- Телитченко М. М., Остроумов С. А. Введение в проблемы биохимической экологии:биотехнология, сельское хозяйство, охрана среды. - М.: Наука, 1990. - 284 с.
- Мышьяк в природных средах и токсикология мышьяка / Панкратов В. М.; Рос. Зеленый Крест. - Б. м., Б.г. - 25 с.
- Ионов Л. Б., Макарова Л. Л., Алексеев В.А. Люизит и другие мышь- яксодержаще компоненты «Камбарской смеси». Химия их превращения в окружающей среде.
- Цветков И. Л., Зарубин С. Л., Урванцева Г. А., Коничев А. С., Филиппович Ю. Б. Кислая фосфотаза гидробионтов как фермент-индикатор биохимической адаптации к воздействию токсических веществ. // Известия АН, серия биологическая, №5. - Москва, 1997.